近日,我校药学院丁娅团队与基础医学与临床药学学院彭娟娟/赵灵之团队合作,在权威期刊ANGEWANDTE CHEMIE-INTERNATIONAL EDITION以“热点论文(Hot Paper)”形式在线发表了题为“A High-Efficiency Bioorthogonal Tumor-Membrane Reactor for In Situ Selective and Sustained Prodrug Activation”的最新研究成果。我校药学院2019级博士研究生马宇为本论文第一作者,基础医学与临床药学学院讲师周蕴赟为本论文的共同第一作者,药学院丁娅教授、基础医学与临床药学学院彭娟娟和赵灵之教授为本文的共同通讯作者,管家婆必出一肖一码一中一特为本文的第一通讯单位。
化疗能有效抑制肿瘤的生长,但其严重的毒副作用限制了其临床应用。尽管利用药物载体将化疗药物精确递送至肿瘤细胞有望解决这一难题,但是目前的药物递送策略仍存在药物提前泄漏、脱靶和内吞介导的药物降解等问题,严重降低了递送效率。利用疏水性化药在浓度梯度驱动下扩散入细胞内部这一原理,在肿瘤细胞表面原位激活前药可以减少药物在递送过程中的损失,缩短化药-靶点间的距离,且降低全身毒副作用。然而,如何在肿瘤表面精准调控前药激活的位置、延长激活持续时间和提高激活效率,仍然存在巨大挑战。
本文提出利用功能化脂质体的肿瘤细胞靶向和膜融合机制,在肿瘤细胞膜表面锚定生物正交反应激活剂(四嗪基修饰的膜锚定分子,DSPE-PEG-Tz),将肿瘤活细胞作为反应器构建基元,在体构建可触发前药激活的膜反应器。该反应器的构建能深入肿瘤内部、稳定保持在瘤内长达96小时以上,并持续激活外源性前药(如反式环辛烯修饰的阿霉素,TCO-Dox)。肿瘤细胞膜表面激活的阿霉素(Dox)通过浓度梯度的驱动作用,精准进入肿瘤细胞核中,发挥药效。此外,通过再次补充功能化脂质体的策略可显著提高正交反应前药激活的反应效率。这种将活体肿瘤组织作为前药激活车间、肿瘤细胞作为反应器的策略,为肿瘤化疗的有效性、选择性和安全性提供了一种通用的方法。
以上工作获得国家自然科学基金面上项目(No. 31870946和32271453)和双一流高校前瞻项目(No. CPU2022QZ12)的资助。
原文链接:https://onlinelibrary.wiley.com/doi/10.1002/anie.202318372
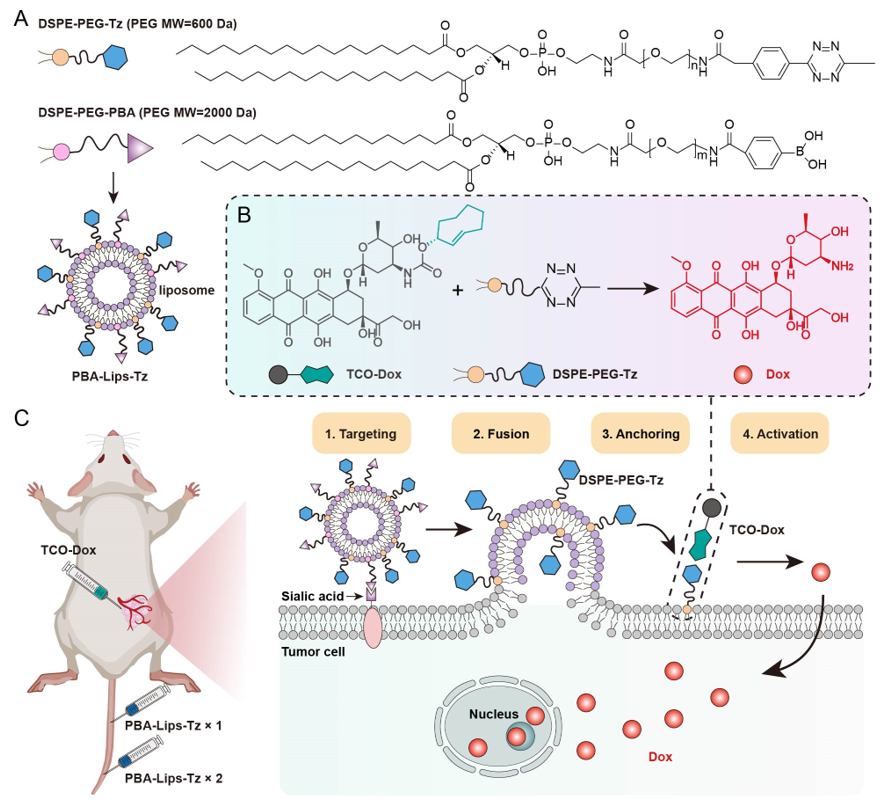
肿瘤细胞膜反应器的构建及其原位生物正交前药激活作用机理示意图
(供稿单位:药学院、基础医学与临床药学学院,撰写人:刘华,审稿人:沈玲玲)






