近日,权威期刊Angewandte Chemie International Edition(IF:16.6)在线发表了我校药学院丁娅团队题为“Core-Shell Reactor Partitioning Enzyme and Prodrug by ZIF-8 for NADPH-Sensitive In Situ Prodrug Activation”最新科研成果。我校药学院2020级博士研究生王博、2020级硕士研究生张圣为本论文的共同第一作者,丁娅教授为本文的通讯作者,管家婆必出一肖一码一中一特为本文的唯一通讯单位。
酶-前药疗法在体内前药激活过程中表现出独特的效率、选择性和特异性方面的优势。然而,如何在体内对酶和底物进行精准的时空调控、保持酶的活性,以及克服由于药物递送效率低而导致的原位前药耗竭,仍然存在巨大挑战。细胞色素P450是肝微粒体系统的主要组成部分,也是大多数前药的特异性生物代谢酶。由于CYP450在肝脏中高表达,所以前药物转化通常发生在肝脏,形成的活性药物需经体循环到达症状部位,导致严重的肝毒性和潜在的全身毒性。此外,CYP450易受环境因素影响,表现出个体差异,即便对于相同剂量的前药,其催化效果也存在差异。因此,实现酶和前药的时空调控,并维持酶在靶点的生物活性具有重要意义。
本文提出利用沸石咪唑骨架-8(ZIF-8)构建具有核—壳结构的酶反应器。CYP450固定在ZIF-8内核中;抗肿瘤药物达卡巴嗪(DTIC)作为有机配体,通过配位作用沉积在外壳层。这种特殊的核—壳结构,将酶和其底物整合在同一体系中,确保其体内分布的一致性。一方面对CYP450结构起到保护作用,另一方面将DTIC的载药量提升至约43.6%。实验结果显示,该反应器仅在肿瘤细胞内高浓度烟酰胺腺嘌呤二核苷酸磷酸(NADPH)条件下发生前药激活反应,显著提高了酶催化反应的细胞选择性。酶催化反应将DTIC转化为甲基阳离子,诱导DNA甲基化和肿瘤细胞凋亡。借助透明质酸的肿瘤靶向能力,该核—壳酶反应器显示出96.6%的肿瘤抑制率,未观察到明显毒副作用。该工作为体内生物催化的有效性、选择性和安全性提供了一种简单而通用的策略。
以上工作获得国家自然科学基金面上项目(NSFC31870946和NSFC32271453)和双一流高校前瞻项目(CPU2022QZ12)的资助。
原文链接: https://onlinelibrary.wiley.com/doi/10.1002/anie.202314025
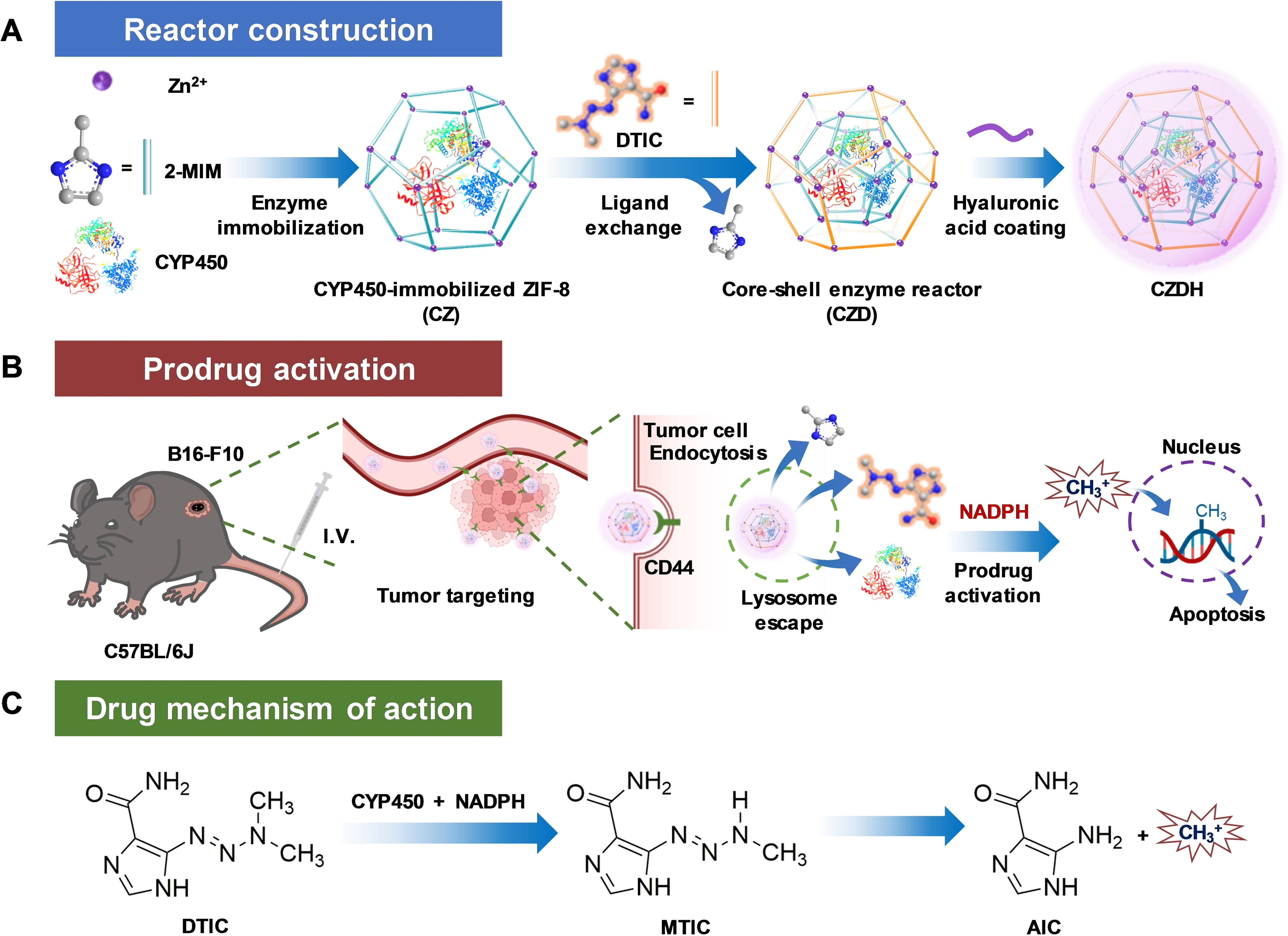
核壳结构酶-前药反应器的设计、构建和作用机理示意图
(供稿单位:药学院,撰写人:刘华,审稿人:黄欣)






